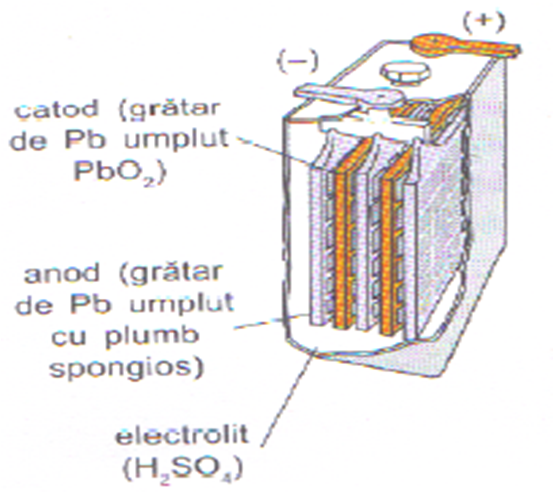
Acumulatorul cu plumb este o pila cu electrolit lichid realizat pentru prima oara, in anul 1859, de inginerul francez Gaston Planté.
Electrodul negativ este format dintr-un gratar de plumb cu ochiurile umplute cu plumb spongios, iar electrodul pozitiv este construit tot dintr-un gratar de plumb cu ochiurile umplute cu dioxid de plumb. Electrolitul este acid sulfuric de concentratie 38% (p = 1,29 g/cm 3 ) pentru acumulatorul incarcat.
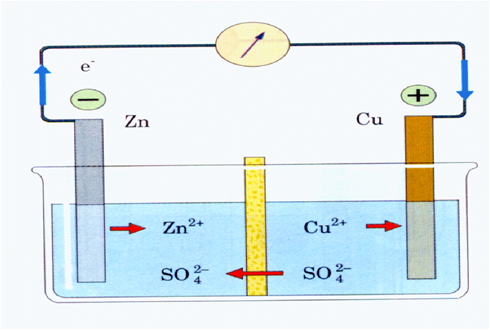
In timpul functionarii acumulatorului, când acesta debiteaza curent electric, la cei doi electrozi au loc procesele care pot fi reprezentate prin ecuatiile:
Reactia totala presupune transformarea Pb si a Pb0 2 in PbSO 4 prin consumarea acidului sulfuric.
La ambii electrozi se formeaza PbSO 4 insolubil, care adera la placi, se sulfateaza. Granulele fine de PbSO 4 formate initial se maresc in timpul functionarii, astfel incat randamentul acumulatorului scade.
Se poate constata daca un acumulator este incarcat sau nu prin masurarea concentratiei acidului sulfuric, mai precis prin determinarea densitatii solutiei.
Acumulatorul poate fi reincarcat prin conectarea acestuia la o sursa de curent continuu astfel, incât curentul debitat de sursa sa aibä sens opus celui debitat de acumulator; la electrozi se produc astfel reactiile inverse celor indicate.
F.e.m. a unei cebule este de aproximativ 2V. Frecvent se utilizeaza baterii formate din trei sau sase celule legate in serie pentru a produce 6 V sau 12 V.
In afara acumulatorilor cu plumb se utilizeaza acumulatoare alcaline de tip Ni-Fe si Ni- Cd. Acestea prezintä avantajul ca permit desfasurarea unui numär mare de descarcári – incarcari fara deteriorarea placilor.